Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ - определение
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, В МОЛЕКУЛАХ КОТОРЫХ СУЩЕСТВУЕТ СВЯЗЬ АТОМА МЕТАЛЛА С АТОМОМ/АТОМАМИ УГЛЕРОДА
Органометаллическое соединение; Металлоорганическое соединение; Металлорганические соединения; Металлорганическое соединение
Найдено результатов: 126
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат в молекуле атом какого-либо металла, непосредственно связанный с атомом углерода, т. е. имеют связь С - М, напр. фениллитий C6H5Li, метилмагнийбромид CH3MgBr, тетраэтилсвинец (C2H5)4Pb. Металлоорганические соединения - реагенты органического синтеза, катализаторы полимеризации в производстве пластмасс и каучуков, фунгициды, бактерициды и др. См. также Элементоорганические соединения.
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
химические соединения, в которых углеродные атомы или органические группы связаны непосредственно с атомами металлов. Металлоорганические соединения играют важную роль в химии, во-первых, поскольку удобны для синтеза других соединений, во-вторых, потому что структуры некоторых из них привели химиков к новым полезным концепциям химической связи и, в-третьих, благодаря тому, что участвуют как нестойкие промежуточные соединения (интермедиаты) в каталитических реакциях.
Первое металлоорганическое соединение, диэтилцинк (C2H5)2Zn, выделено в 1847 английским химиком Э.Франклендом, который пытался удалить атом иода из этилиодида C2H5I посредством реакции с цинком. В действительности реакция протекала по уравнению
2C2H5I + 2Zn . (C2H5)2 Zn + ZnI2
и Франкленд получил бесцветную жидкость, диэтилцинк, которая самовоспламенялась при контакте с воздухом и бурно реагировала с водой. (Большинство металлоорганических соединений чрезвычайно реакционноспособны и обычно возгораются на воздухе.) Примерно в то же время в Копенгагене датский химик В.Цейзе также случайно получил соль K (соль Цейзе), содержащую, как стало известно позднее, этилен, связанный с платиной.
Эти вещества являются представителями двух главных классов металлоорганических соединений: тех, у которых связи металла с углеродом (M-C) локализованы, и тех, где они делокализованы (в случае переходных металлов). В соединениях первого класса, образуемых всеми металлами, органические группы объединены простыми связями, например, M-CH3 или M-C6H5. Существуют также соединения типов M=CR2 и M?CR, с двойными и тройными металл?углеродными связями, - это карбеновые и карбиновые соединения соответственно.
Другой большой класс металлоорганических соединений . ?-комплексы. Их называют так потому, что в химическом связывании с d-орбиталями переходных металлов участвуют ?-электроны и ?-орбитали ненасыщенных органических соединений с C=C-, C?C-, C=N- и т.п. связями (см. также ХИМИЯ ОРГАНИЧЕСКАЯ; МОЛЕКУЛ СТРОЕНИЕ). ?-Комплексы включают все соединения, где органическая группа с кратными углерод?углеродными связями присоединена к переходному металлу.
?-Комплексы. У этилена связь направлена перпендикулярно оси связи C=C (а); циклические олефины могут быть связаны по схеме б; ароматические кольца - нейтральные, как в бензоле C6H6, или заряженные, как у циклопентадиенил-аниона C5H5-, . могут быть связаны по схеме в. Первое и наиболее известное из таких "сандвичевых" соединений . ферроцен (C5H5)2Fe . имеет структуру типа в. Ацетилены могут быть связаны с двумя атомами металлов по схеме г. Известны тысячи ?-комплексов, многие из них . со сложными структурами.
См. также:
Металлоорганические соединения
органические соединения, содержащие атом какого-либо металла, непосредствнно связанный с атомом углерода.
Все М. с. можно подразделить на две группы: 1. М. с. непереходных и часть М. с. переходных металлов. Эти соединения содержат одинарную (σ) связь металл - углерод. 2. М. с. переходных металлов (в т. ч. Карбонилы металлов), построенные путём заполнения s-, p- и d-орбиталей атома металла π-электронами различных ненасыщенных систем, например ароматических, олефиновых, ацетиленовых, аллильных, циклопентадиенильных.
Из М. с. 1-й группы наиболее полно изучены производны Li, Na, К, Be, Mg, Zn, Cd, Hg, B, Al, Tl, Ge, Sn, Pb, As и Sb. Свойства этих соединений определяются характером связи М-С (М - атом металла), зависящей главным образом от природы металла, а также от характера и числа органических радикалов, связанных с атомом металла. В М. с. щелочных металлов связь М-С сильно поляризована, причём на атоме металла сосредоточен частичный положительный, а на атоме углерода - частичный отрицательный заряд:
Поэтому такие М. с. весьма реакционноспособны: они энергично разлагаются водой и очень чувствительны к действию кислорода. Практически их используют только в растворах (углеводороды, эфир, тетрагидрофуран и др.), защищая от влаги, CO2 и кислорода воздуха. Аналогичные свойства присущи соединениям щёлочноземельных металлов (Mg, Ca), а также Zn, Cd, В и Al. Например, такие вещества, как (CH3)2Zn, (CH3)3B, (C2H5)3Al, воспламеняются на воздухе. Более стабильны смешанные М. с. этих элементов, в которых металл связан с органическим радикалом и с 1 или 2 кислотными остатками, например (C2H)2AICI, C2H5AlCl2. С возрастанием электроотрицательности металла полярность связи М - С уменьшается, и соединения таких металлов, как Hg, Sn, Sb и т.п., по существу ковалентны. Это перегоняющиеся жидкости или кристаллические вещества, устойчивые к действию кислорода и воды. При нагревании они распадаются с образованием металла и свободных органических радикалов, например:
(C2H5)4Pb → Pb + 4C2H5.
М. с. 1-й группы могут быть получены взаимодействием металлов с галогеналкилами (или галогенарилами):
н-C4H9Br + 2Li → н-C4H9Li + LiBr
присоединением гидридов или солей металлов по кратной связи:
3CH2=CH2 + AlH3 → (C2H5)3Al
взаимодействием диазосоединений с солями металлов:
2CH2N2 + HgCl2 → ClCH2HgCH2Cl + 2N2
взаимодействием М. с. с галогенидами металлов, металлами и друг с другом:
3C6H5Li + SbCl3 → (C6H5)3Sb + 3LiCl
(C2H5)2Hg + Mg → (C2H5)2Mg + Hg
(CH2=CH)4Sn + 4C6H5Li → (C6H5)4Sb + 4CH2=CHLi.
М. с. переходных металлов, относящиеся к 1-й группе, склонны к гомолитическому распаду (алкильные производные Ag, Cu и Au); арильные и алкенильные соединения этих элементов более стабильны, очень прочны ацетилениды, а также метильные соединения платины, например (CH3)3PtI и (CH3)4Pt.
В М. с. 2-й группы атом металла взаимодействует со всеми атомами углерода π-электронной системы. Типичные представители этого класса М. с. - ферроцен, дибензолхром, бутадиен-железо-трикарбонил. Для соединений этого типа, полученных сравнительно недавно, классическая теория валентности оказалась непригодной (об их электронном строении см. Валентность).
М. с. сыграли большую роль в развитии представлений о природе химической связи (См. Химическая связь). Их используют в органическом синтезе, особенно Литийорганические соединения и Магнийорганические соединения. Многие из М. с. нашли применение в качестве антисептиков, лекарственных и физиологически активных веществ, антидетонаторов (например, тетраэтилсвинец (См. Антиокислители)), антиокислителей (См. Антиокислители), стабилизаторов для полимеров и т.д. Очень важно получение чистых металлов через карбонилы и М. с. при производстве полупроводников и нанесении металлопокрытий. М. с. - промежуточные вещества в ряд важнейших промышленных процессов, катализируемых металлами, их солями и комплексными металлоорганическими катализаторами (например, гидратация и циклополимеризация ацетилена, анионная, в том числе и стереоспецифическая, полимеризация олефинов и диенов, карбонилирование непредельных соединений). См. также Алюминийорганические соединения (См. Мышьякорганические соединения), Мышьякорганические соединения, Сераорганические соединения (См. Несмеянова реакция), Сурьмаорганические соединения, Цинкорганические соединения, Гриньяра реакция, Несмеянова реакция, Кучерова реакция (См. Переходные элементы), Вюрца реакция, Переходные элементы, Ферроцен (См. Полимеры), Полимеризация.
Лит.: Химия металлоорганических соединений, под ред. Г. Цейсса, пер. с англ., М., 1964; Рохов Ю., Херд Д., Льюис Р., Химия металлоорганических соединений, пер. с англ., М., 1963.
Б. Л. Дяткин.
Металлоорганические соединения
Металлоорганические соединения (МОС) — органические соединения, в молекулах которых существует связь атома металла с атомом/атомами углерода.
Сераорганические соединения
Серосодержащие соединения; Серусодержащие соединения; Тиосоединения; Тиоорганические соединения; Серосодержащие органические соединения; Сероорганические соединения; Тио; Тио-
Сераоргани́ческие соедине́ния — обширный класс химических соединений, содержащих в молекуле связь углерод — сера.
Сераорганические соединения
Серосодержащие соединения; Серусодержащие соединения; Тиосоединения; Тиоорганические соединения; Серосодержащие органические соединения; Сероорганические соединения; Тио; Тио-
вещества, содержащие в молекуле связь углерод - сера. С. с. многочисленны и разнообразны; сера, наряду с водородом, кислородом, азотом и галогенами, - один из основных элементов-органогенов. В С. с. атом S может находиться в любой характерной для него степени окисления: S (-2), S (+4) и S (+6). Главные типы С. с. (R, R', Ar - органический остаток): 1) содержащие S (-2) - Меркаптаны (тиоспирты) RSH, Тиофенолы ArSH, тиоальдегиды R - CH=S и тиокетоны R - CS - R', Тиокислоты 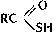 (тиоловые кислоты),
(тиоловые кислоты),  (тионовые кислоты) и
(тионовые кислоты) и 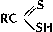 (дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты
(дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты 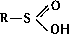 и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
Основные методы синтеза С. с. основаны на реакциях органических соединений с элементарной серой или её простейшими неорганическими соединениями:
H2S, Na2S, NaSH, SCI2, SO2, SO3, H2SO4.
Ниже приведены схемы некоторых реакций:
Ar - H + H2SO4 → ArSO3H + H2O
Большое значение имеют также методы, основанные на взаимных превращениях С. с.
К С. с. принадлежат многие важные природные вещества, например аминокислоты Цистеин и Метионин, ряд коферментов (См. Коферменты) (кофермент А, липоевая кислота), витаминов (тиамин, биотин), антибиотиков (например, Пенициллины). Сульфгидрильные группы цистеина играют важную роль в активном центре многих ферментов. Дисульфидные связи цистина, образующиеся в результате связывания двух остатков цистеина, участвуют в поддержании пространственной структуры белков (См. Белки) и пептидов. К С. с. относятся также многочисленные лекарственные и физиологически активные синтетические вещества, в том числе Сульфаниламидные препараты, Радиозащитные средства (цистамин, цистафос и др.), инсектофунгициды и ростовые вещества, отравляющие вещества (иприт), Красители различных классов - сернистые, некоторые анилиновые, антрахиноновые, фталоцианиновые. Как С. с. можно рассматривать и некоторые высокомолекулярные соединения, например Полисульфидные каучуки (тиоколы); на образовании С. с. основана Вулканизация каучуков серой (и сё производными). С. с. используются в качестве ингибиторов полимеризации и окисления, стабилизаторов полимерных материалов (меркаптобензимидазол и др.), растворителей (тетраметиленсульфон, диметилсульфоксид). Соли органических сульфокислот применяют как поверхностно-активные вещества (Моющие средства). Многие С. с., например ароматические сульфокислоты, - важные полупродукты основного органического синтеза.
Б. Л. Дяткин.
Фторорганические соединения
ГАЛОГЕНОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ХОТЯ БЫ ОДИН АТОМ ФТОРА, СОЕДИНЁННЫЙ НАПРЯМУЮ С УГЛЕРОДОМ
Фторкаучук; Фторсодержащие органические соединения
органическое соединения, содержащие в молекулах одну или несколько связей F-C. Химия Ф. с. начала интенсивно развиваться лишь со 2-й половины 20 в., но уже выросла в большую специализированную область органической химии (См. Органическая химия). Её развитие было обусловлено потребностями молодой атомной промышленности в материалах, стойких к фторирующему действию UF6, который применяется для изотопов разделения (См. Изотопов разделение) урана. Известны фторпроизводные всех типов органических соединений.
Номенклатура. Положение атома фтора в Ф. с. обозначают согласно правилам номенклатуры органических соединений (см. Номенклатура химическая). Для построения название полифторзамещённых соединений удобнее пользоваться приставкой "пер". Так, полностью фторировнные углеводороды называются перфторуглеводородами (или фторуглеродами), например CF3(CF2)5CF3 называется перфторгептаном. Частично фторированные соединения можно рассматривать как производные перфторуглеводородов, например CF3CFH (CF2) CF2H называется 1,6-дигидроперфторгептаном. Очень часто в название Ф. с. сочетание "перфтор" заменяют греческой буквой φ; в этом случае, например, перфторэтан называется φ-этаном. Для обозначения полностью фторированных углеводородов используют также частицу "фор" (фтор), которую включают в наименование соответствующего углеводорода, например название CF4 - метфоран, C2F6 - этфоран.
Методы синтеза. Прямое фторирование, а также присоединение F2 по двойной связи - радикальные чрезвычайно экзотермические реакции:
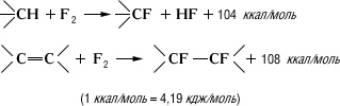
(1ккал/моль = 4,19 кдж/моль)
Т. к. тепловой эффект фторирования больше, чем разрыва С-С-связей (80-85 ккал/моль), возможна деструкция фторируемых соединений. Во избежание этого необходим эффективный отвод тепла и разбавление смеси реагирующих веществ азотом. Для отвода тепла в реакционное пространство (трубка) вводят медную сетку или медные стружки, покрытые Ag, Co, Ni или др.; на поверхности сетки (стружек) образуются высшие фториды металлов, которые и служат фторирующими агентами, роль фтора при этом сводится, по-видимому, к их регенерации.
В металлофторидном процессе пары фторируемого вещества, сильно разбавленные азотом, пропускают через трубку с CoF3:
1/2 (-CH2-) + 2CoFз → 1/2(-CF2-) + HF+ 2CoF2 + 46 ккал/моль.
Образующийся CoF3 действием фтора при 250°С превращают опять в CoF3. Выходы перфторуглеводородов 80-85\%.
Важен метод электрохимического фторирования. Электролитом служит раствор фторируемого вещества в безводном фтористом водороде. В случае неэлектропроводных соединений обычно добавляют KF. Этим методом φ-амины, φ-окиси и др. Все рассмотренные выше процессы применяются в промышленности.
Обмен атомов хлора на фтор - важный промышленный метод введения фтора (см. Свартса реакция); может быть произведён безводным HF или фторидами (См. Фториды) (например, NH4F, KF, CbF3Cl2, AgF2, HgF2. Лёгкость обмена зависит от строения хлорсодержащего соединения. Так, хлорангидриды кислот часто легко превращаются во фторангидриды путём растворения их в безводном HF. Атомы Cl в этиленхлоргидрине, хлоруксусной кислоте и её производных легко обмениваются на F при реакции с KF в полярных растворителях (например, этиленгликоле); в моногалогенуглеводородах - лишь действием AgF2 или HgF2 при 150°С. Легче замещаются на фтор атомы хлора в соединениях, содержащих трихлорметильную группу. В промышленности для такого обмена применяют обычно растворы SbF3 или SbF3Cl2 в безводном HF. Этим способом из хлороформа CHCl3 получают дифторхлорметан, используемый для производства тетрафторэтилена, из CCl4 - дифтордихлорметан (один из важнейших фреонов (См. Фреоны)), из C2Cl6 - трифтортрихлорэтан (исходное вещество для производства трифторхлорэтилена).
Сравнительно легко на фтор обмениваются атомы хлора в гексахлорбензоле (действием KF при 450-530°С); C6F6 и C6F5Cl при этом получаются с хорошими выходами. Аналогично реагируют и др. полихлорароматические и полихлоргетероциклические соединения.
Диазометод получения фторароматических соединений основан на образовании борфторида выделяют в твёрдом при нагревании:
Замена кислородсодержащих группировок в различных органических соединениях на фтор при помощи SF4 (например, в спиртах, альдегидах, кетонах, кислотах):
(R - органический остаток).
Присоединение безводного фтористого водорода к олефинам, галогенолефинам, окисям, изоцианатам, циклопарафинам и др., например:
Сопряжённое присоединение фтора и др. атомов или групп к соединениям, содержащим кратные связи, легко происходит в избытке безводного HF, например фторнитрование:
Методы получения фторолефинов. Дегалогенирование вицинальных дигалогенполифторалканов металлами (Zn, Mg и др.), например:
CF2Cl - CF2Cl + Zn → CF2 = CF2 + ZnCl2.
Пиролиз политетрафторэтилена, приводящий к образованию перфторпропилена и перфторизобутилена наряду с тетрафторэтиленом, перфторбутиленом, фторциклобутаном и др.:
[-CF2-] n → CF3F = CF2 + (CF3)2C = CF2 + CF2 = CF2 + CF3CF2CF = CF2 и др.
В промышленности этим способом (а также пиролизом тетрафторэтилена) получают перфторпропилен - важный мономер для производства фторкаучуков.
Пиролиз солей φ-карбоновых кислот, например:
Фторированные спирты получают обычными методами синтеза спиртов (См. Спирты), например восстановлением эфиров φ-карбоновых кислот, фторированных альдегидов и кетонов. Важный промышленный способ их получения - Теломеризация тетрафторэтилена метанолом:
nCF2 = CF2 + CH3OH → Н [-CF2CF2-] n СН2ОН.
Свойства. Физические свойства. Низшие фторуглероды парафинового ряда (общая формула CnF2n+2) - газы, начиная с C5 - жидкости, высшие - твёрдые воскообразные соединения. Только первые четыре представителя этого ряда кипят несколько выше соответствующих углеводородных аналогов, все остальные - ниже.
При замещении одного атома водорода в молекуле углеводорода на F температура кипения повышается, но меньше, чем при замене его на хлор. При полной замене атомов водорода на фтор у любых производных углеводородов температуры кипения очень сильно понижаются (см. табл.).
Сравнение температур кипения некоторых соединений
Фторуглероды - хорошие диэлектрики (удельное электрическое сопротивление около 1014 ом (см; диэлектрическая проницаемость их значительно выше, чем у парафинов. Скорость распространения ультразвука во фторуглеродах необычайно низка (менее 800 м/сек).
Химические свойства наиболее важных типов Ф. с. Фторуглероды парафинового и алициклических рядов характеризуются необычайно высокими химической инертностью и термостойкостью. Для них известно небольшое число реакций, осуществляемых лишь при высоких температурах. Так, пиролиз перфторэтана начинается около 1000°C, перфторгептана - около 800°C. Фторуглероды не реагируют в обычных условиях и при умеренном нагревании с концентрированными кислотами, сильными окислителями, металлами, щелочами и др.; реакция с металлическим натрием и перекисью натрия начинается при 400°C; Zn, Al, Fe и Sn в этих условиях реагируют очень медленно; Cu, Ag, Hg и некоторые др. в реакцию не вступают.
Перфторбензол и некоторые др. перфторароматические соединения легко взаимодействуют с нуклеофильными реагентами, например с аммиаком, аминами, алкоголятами, сульфидом натрия и др. При этом после замены одного атома фтора замещается второй, находящийся в пара- (См. Мета-, орто-, пара-)положении к первому:
Пентафторхлорбензол образует магнийорганическое соединение (См. Магнийорганические соединения) C6F5MgCl, широко используемое в органическом синтезе.
Перфторолефины, в отличие от олефинов, являющихся нуклеофилами, резко электрофильны. Они легко реагируют с различными нуклеофилами (см. Нуклеофильные и электрофильные реагенты), причём в зависимости от типа последних образуются продукты присоединения или замещения атома F в винильном (а) или аллильном (б) положении на остаток нуклеофила (Nu):
Электрофильные соединения реагируют с фторолефинами значительно труднее, чем с их углеводородными аналогами. Однако фторолефины присоединяют галогены, смешанные галогены, серный ангидрид и др. сильные электрофильные реагенты. Перфторолефины легко вступают в радикальные реакции, например
CF2 = CF2 + N2O4 → CF2NO2 - CF2NO2 + CF2NO2 - CF2ONO,
легко полимеризуются и сополимеризуются (см. Фторопласты, Фторкаучуки). При окислении φ-олефинов в щелочной среде образуются φ-окиси (см. ниже).
Монофторметанол - нестойкая жидкость, tkип 51°C; ди- и трифторметанолы не получены, но известны производные трифторметанола: трифторметилгипофторит CF3OF - газ, tkип - 95°C, и алкоголяты CF3OK и CF3OCs. Фторзамещённые спирты (β-, γ-, но не α-) - устойчивые, легко перегоняющиеся жидкости. Кислотные свойства спиртов усиливаются по мере накопления атомов фтора.
С увеличением содержания фтора в молекулах альдегидов и кетонов электрофильность карбонильного атома углерода резко усиливается. Перфторальдегиды и перфторкетоны, подобно хлоралю, образуют стойкие геминальные диолы, например CF3-CH (OH)2, CF3-C (OH)2-CF3, и полуацетали; легче, чем их углеводородные аналоги, присоединяют NH3, HCN, NH2OH и др. нуклеофильные реагенты; легко подвергаются распаду с образованием фтороформа, например:
CF3COCF3 + NaOH → CF3H + CF3COONa.
Частично фторированные кетоны и альдегиды характеризуются высоким содержанием енольных форм (см. Таутомерия), склонных к образованию внутрикомплексных соединений; это свойство их используется для разделения редких и рассеянных элементов, например с помощью теноилтрифторацетона выделяют и очищают Be, Со, Hf, Zr, Ас, а также радиоактивные изотопы, образующиеся в ядерном реакторе.
Фторзамещённые карбоновые кислоты сильнее незамещённых и соответствующих хлорзамещённых кислот. Однако n-фторбензойная кислота слабее хлорбензойной вследствие большей способности атома F к сопряжению.
Под влиянием третичных аминов или ионов фтора φ-окиси легко изомеризуются, а также полимеризуются, образуя исключительно стойкие к действию агрессивных сред масла.
Первичные и вторичные перфторалкиламины типа CF3NH2 и (CF3)2NH малоустойчивы, третичные - исключительно стойки к действию самых агрессивных сред; они лишены основных свойств вследствие сильного снижения электронной плотности на атоме азота.
Разнообразные органические соединения, несущие группы - NF2, являются сильными окислителями.
Фторнитрозосоединения типа RFN = O устойчивы; в отличие от водородных аналогов, окрашены в интенсивно-синий цвет, например трифторнитрозометан - синий газ, tkип - 84°C. При сополимеризации последнего с тетрафторэтиленом получается один из наиболее химически стойких фторкаучуков, т. н. нитрозокаучук.
Из Ф. с., содержащих серу, известны, например, фтормеркаптаны, сульфиды, ди- и полисульфиды, сульфоокиси, сульфоны, сульфоновые кислоты и их производные; промышленное применение нашли перфторсульфокислоты, в частности Трифторметансульфокислота, и дифтортиофосген CF2S (в синтезе эластомеров).
Из фторалкильных соединений металлов и металлоидов наибольшее значение имеют соединения с Li, Mg, Hg, Si; сравнительно хорошо изучены соединения с Р, As, Sb. Перфтордиметилртуть (CF3)2Hg резко отличается от обычных ртутьорганических соединений. Это бесцветное кристаллическое вещество, tпл 161°C, хорошо растворимо в воде; в отличие от (CH3)2Hg, практически не алкилирует. Диперфторвинилртуть - хороший перфторвинилирующий агент. Из соединений кремния наибольшее значение имеет CF3CH2CH2SiCl2((CH3), применяемый для производства термостойкого фторсилоксанового эластомера (см. Кремнийорганические каучуки).
Применение. Ф. с. широко применяются во всех областях техники с её экстремальными условиями эксплуатации. Ф. с. используют для получения фторопластов, превосходящих благородные металлы по устойчивости к действию агрессивных сред; термостойких фторкаучуков; антикоррозионных покрытий; как негорючие, термостойкие и неокисляющиеся смазочные масла и гидравлические жидкости; поверхностно-активные и пламягасящие вещества, пропелленты и хладагенты (см. Фреоны). Трифторуксусная кислота и её ангидрид применяются как промоторы этерификации; трифторнадуксусная кислота - специфический и удобный окислитель. В медицине Ф. с. применяют как лекарственные препараты и средства для наркоза (см. Фторотан), как материалы для изготовления искусственных кровеносных сосудов, клапанов для сердца. Кроме того, на примере Ф. с. изучены фундаментальные вопросы теории: природа водородной связи, вандерваальсовы силы, механизмы реакций и др.
Лит.: Кнунянц И. Л., Фокин А. В., Покорение неприступного элемента, М., 1963; Кнунянц И. Л., Сокольский Г. А., Электрохимическое фторирование, в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957; Шеппард У., Шартс К., органическая химия фтора, пер. с англ., М., 1972; Успехи химии фтора, пер. с англ., т. 1-4, Л., 1964-70; Fluorine chemistry reviews, ed. P. Tarrant, v. 1-7, N. Y. - [a. o.], 1967-74; Chambers R. D., Fluorine in organic chemistry, N. Y. - [a. o.], 1973.
И. Л. Кнунянц.
ФТОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ГАЛОГЕНОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ХОТЯ БЫ ОДИН АТОМ ФТОРА, СОЕДИНЁННЫЙ НАПРЯМУЮ С УГЛЕРОДОМ
Фторкаучук; Фторсодержащие органические соединения
содержат в молекуле один или несколько атомов фтора, непосредственно связанных с атомом углерода. Фторорганические соединения - смазочные масла, гидравлические жидкости, фторопласты, фторкаучуки, фреоны, красители; в медицине - средства для наркоза, кровезаменители и др.
Фторорганические соединения
ГАЛОГЕНОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ХОТЯ БЫ ОДИН АТОМ ФТОРА, СОЕДИНЁННЫЙ НАПРЯМУЮ С УГЛЕРОДОМ
Фторкаучук; Фторсодержащие органические соединения
Фторорганические соединения (органические соединения фтора) — это галогенорганические соединения, содержащие хотя бы один атом фтора, соединённый напрямую с углеродом.
АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Алифатические углеводороды; Ациклические соединения; Алифатический радикал; Алифатическое соединение; Жирного ряда соединения
то же, что алифатические соединения.
Википедия
Металлоорганические соединения
 complex.png?width=120)
Металлоорганические соединения (МОС) — органические соединения, в молекулах которых существует связь атома металла с атомом/атомами углерода.

 complex.png?width=200)
![[[Этан]] (трёхмерная модель) [[Этан]] (трёхмерная модель)](https://commons.wikimedia.org/wiki/Special:FilePath/Ethane-3D-vdW.png?width=200)
![[[Изобутан]] (трёхмерная модель) [[Изобутан]] (трёхмерная модель)](https://commons.wikimedia.org/wiki/Special:FilePath/Isobutane3.png?width=200)
![[[Ацетилен]] (трёхмерная модель) [[Ацетилен]] (трёхмерная модель)](https://commons.wikimedia.org/wiki/Special:FilePath/Acetylene-3D-vdW.png?width=200)
![[[Циклопропан]] (структурная формула) [[Циклопропан]] (структурная формула)](https://commons.wikimedia.org/wiki/Special:FilePath/Cyclopropane-2D.png?width=200)
![Циклогекс-2-енон]] ( структурная формула) Циклогекс-2-енон]] ( структурная формула)](https://commons.wikimedia.org/wiki/Special:FilePath/Cyclohexenone.png?width=200)
![[[Циклопропан]] (3D-формула) [[Циклопропан]] (3D-формула)](https://commons.wikimedia.org/wiki/Special:FilePath/Cyclopropane-3D-vdW.png?width=200)
![Циклогекс-2-енон]] (3D-формула) Циклогекс-2-енон]] (3D-формула)](https://commons.wikimedia.org/wiki/Special:FilePath/Cyclohexenone 3D spacefill.png?width=200)
![[[Кубан]] (3D-формула) [[Кубан]] (3D-формула)](https://commons.wikimedia.org/wiki/Special:FilePath/Cubane molecule spacefill.png?width=200)
